Idea Przejrzystości to inicjatywa samoregulacyjna innowacyjnych firm farmaceutycznych realizowana od 2015 r., która została zainicjowana przez Europejską Federację Przemysłu i Stowarzyszeń Farmaceutycznych EFPIA. Idea Przejrzystości zakłada transparentność poprzez udostępnianie opinii publicznej informacji na temat zakresu i wartości współpracy innowacyjnej branży farmaceutycznej z przedstawicielami zawodów medycznych, organizacjami ochrony zdrowia oraz organizacjami pacjentów oraz wpisuje się w rosnące oczekiwania społeczne dotyczące przejrzystości.
W Polsce, zasady przejrzystości współpracy z przedstawicielami zawodów medycznych, organizacjami ochrony zdrowia zostały wdrożone w Kodeksie Przejrzystości Związku Pracodawców Innowacyjnych Firm Farmaceutycznych INFARMA (dalej „Kodeks Przejrzystości). Kodeks Przejrzystości został wdrożony w 2015 r. i obowiązywał 33 firmy farmaceutyczne, w tym 29 firm zrzeszonych w INFARMIE. Natomiast sposób udostępniania współpracy z Organizacjami Pacjentów regulowały zapisy znowelizowanego w tym samym roku Kodeksu Dobrych Praktyk Przemysłu Farmaceutycznego.
1 stycznia 2021 r. Kodeks Przejrzystości oraz Kodeks Dobrych Praktyk Przemysłu Farmaceutycznego zostały skonsolidowane i zastąpione Kodeksem Dobrych Praktyk INFARMA (na poziomie europejskim the EFPIA Code of Practice).
Pierwszym okresem raportowanym zgodnie z postanowieniami Kodeksu Dobrych Praktyk INFARMA, jest rok 2021.
Do raportów składanych za wcześniejsze lata stosuje się regulacje Kodeksu Przejrzystości.
Idea Przejrzystości powstała z inicjatywy innowacyjnej branży farmaceutycznej, która uważa że współpraca między branżą farmaceutyczną a przedstawicielami zawodów medycznych, organizacjami ochrony zdrowia oraz organizacjami pacjentów powinna być transparentna i podlegać ścisłym regułom, co umożliwi rzetelną i obiektywną ocenę wartości tej współpracy dla systemu ochrony zdrowia i dobra pacjentów.
Na poziomie europejskim Idea Przejrzystości została wdrożona poprzez samoregulację w postaci Kodeksu Przejrzystości poprzez Europejską Federację Przemysłu i Stowarzyszeń Farmaceutycznych EFPIA zobowiązującą stowarzyszenia krajowe do wdrożenia zasad udostępniania opinii publicznej informacji na temat zakresu i wartości współpracy innowacyjnych firm farmaceutycznych z przedstawicielami zawodów medycznych, organizacjami ochrony zdrowia oraz organizacjami pacjentów. Jego zapisy wdrażają równocześnie 37 stowarzyszenia członkowskie EFPIA. (https://www.efpia.eu/relationships-code/national-codes/).
W Polsce, w stosunku do przedstawicieli zawodów medycznych, organizacji ochrony zdrowia idea ta została wdrożona poprzez Kodeks Przejrzystości. Natomiast, transparentność współpracy z organizacjami pacjentów została uregulowana Kodeksie Dobrych Praktyk Przemysłu Farmaceutycznego.
1 stycznia 2021 r. Kodeks Przejrzystości oraz Kodeks Dobrych Praktyk Przemysłu Farmaceutycznego zostały skonsolidowane i zastąpione Kodeksem Dobrych Praktyk INFARMA.
Wszystkie firmy farmaceutyczne, które przystąpiły do Kodeksu Dobrych Praktyk INFARMA (Sygnatariusze Kodeksu) zbierają, a następnie publikują na swych stronach internetowych informacje dotyczące wartości współpracy z przedstawicielami zawodów medycznych w zdefiniowanych kategoriach – koszty poniesione w związku z wydarzeniami (opłaty rejestracyjne, koszty podróży i zakwaterowania) oraz wynagrodzenia z tytułu świadczonych usług.
Przedstawiciel zawodu medycznego definiowany jest w Kodeksie jako każda osoba fizyczna:
- będąca lekarzem, lekarzem dentystą, farmaceutą, felczerem (starszym felczerem), pielęgniarką, położną, diagnostą laboratoryjnym, ratownikiem medycznym lub technikiem farmaceutycznym, lub
- inna niż wymienione w lit. a. powyżej, która w ramach wykonywanego zawodu uprawniona jest do przepisywania, nabywania, dostarczania, zalecania lub podawania produktów leczniczych, której główne miejsce wykonywania zawodu znajduje się na terytorium Europy.
Za Przedstawicieli zawodów medycznych Kodeks uznaje również: (i) urzędników lub pracowników organu administracji, organizacji lub instytucji, działającej w sektorze publicznym lub prywatnym, który to podmiot może nabywać, dostarczać (z wyłączeniem hurtowni) lub podawać Produkty lecznicze, jeżeli osoby te uczestniczą w procesie nabywania, dostarczania lub podawania Produktów leczniczych; oraz (ii) osoby zatrudnione przez Sygnatariusza Kodeksu na podstawie umowy o pracę lub umowy cywilnoprawnej, których podstawowym zajęciem jest wykonywanie zawodów wskazanych w lit. a. i b. powyżej.
Kodeks zakłada, że w przypadku podmiotów współpracujących będących osobami fizycznymi, Sygnatariusz Kodeksu zobowiązany jest zapewnić, aby udostępnienie informacji nastąpiło bez uszczerbku dla praw co do ochrony jego danych osobowych.
W praktyce stosowana jest zasada dobrowolności przedstawicieli zawodów medycznych w podejmowaniu decyzji dotyczącej zgody na publikowanie informacji. W przypadku braku zgody na udostępnienie informacji o wartości indywidualnej współpracy, wartości te publikowane są w postaci zagregowanej.
Do raportów składanych zawcześniejsze lata stosuje się regulacjeKodeksu Przejrzystości.
Dane podlegające udostępnieniu w przypadku przedstawicieli zawodów medycznych są następujące:
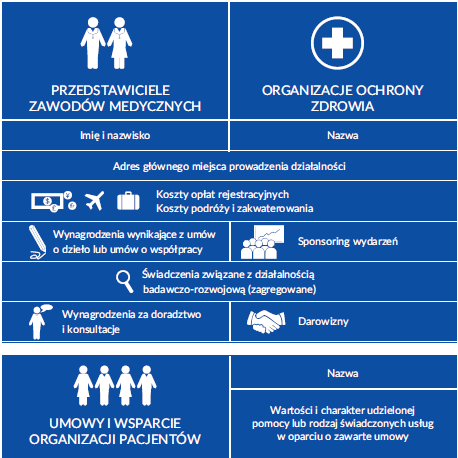
Współpraca z organizacjami ochrony zdrowia oraz organizatorami wydarzeń naukowych.
Organizacją ochrony zdrowia w rozumieniu Kodeksu Dobrych Praktyk INFARMA (Kodeks) jest każdy podmiot:
- będący placówką opieki zdrowotnej, organizacją medyczną lub organizacją naukową z zakresu zdrowia lub medycyny, niezależnie od jego formy organizacyjnej i prawnej, taki jak szpital, klinika, fundacja, uczelnia, inna instytucja dydaktyczna lub towarzystwo naukowe (z wyłączeniem Organizacji pacjentów), lub
- za pośrednictwem którego udzielane są świadczenia przez (jednego lub więcej) Przedstawicieli zawodów medycznych, z siedzibą lub głównym miejscem prowadzenia działalności na Terytorium Europy.
Za organizacje ochrony zdrowia nie są uważani przedsiębiorcy prowadzący obrót hurtowy lub detaliczny Produktami leczniczym.
Firmy komercyjne, które organizują wydarzenia naukowe dla przedstawicieli zawodów medycznych, mogą być uznane za organizację ochrony zdrowia i podlegać raportowaniu zgodnie z zasadami Kodeksu, jeśli jednocześnie są gospodarzem i podmiotem zapraszającym na dane wydarzenie. Jeśli natomiast organizują one dane wydarzenie w imieniu innej organizacji ochrony zdrowia (np. towarzystwa naukowego, stowarzyszenia, kliniki, szpitala), raportowaniu podlegać będzie organizacja będąca faktycznym gospodarzem wydarzenia – nawet, jeśli Sygnatariusz Kodeksu przekazał świadczenie (np. w ramach umowy sponsorskiej) firmie, pełniącej funkcję organizatora logistycznego danego wydarzenia.
Podstawowe zasady udostępniania świadczeń na rzecz organizacji ochrony zdrowia
- Zgodnie z Kodeksem każdy z Sygnatariuszy Kodeksu zobowiązany jest podać do publicznej wiadomości informacje o świadczeniach dla organizacji ochrony zdrowia. Sygnatariusze Kodeksu publikują na swoich stronach internetowych raporty zawierające informacje o świadczeniach. Znajdują się w nich dane za poprzedni rok kalendarzowy.
- W raportach udostępnione są następujące dane organizacji ochrony zdrowia:
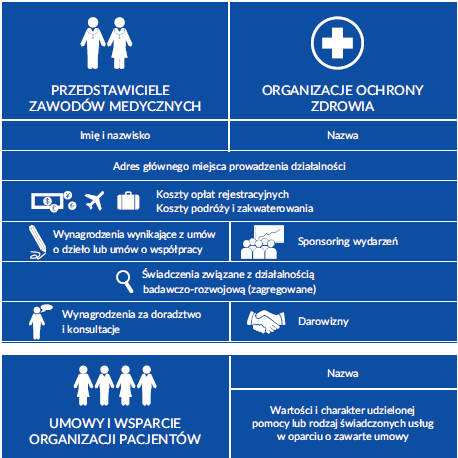
-
Zgodnie z Kodeksem upublicznieniu podlegają nie tylko Świadczenia przekazywane przez Sygnatariuszy Kodeksu bezpośrednio na rzecz organizacji ochrony zdrowia, ale także za pośrednictwem podmiotu występującego w jej imieniu.
W przypadku Świadczeń przekazanych organizacji ochrony zdrowia za pośrednictwem organizatora logistycznego (osoby trzeciej) należy zaraportować Organizację ochrony zdrowia jako Beneficjenta.
W nocie metodologicznej, opisującej zasady raportowania, znajdzie się również wyjaśnienie, że część lub wszystkie świadczenia zostały przekazane na konta tzw. organizatorów logistycznych, czyli np. firm zajmujących się organizacją wydarzeń.
Z taką właśnie sytuacją mamy do czynienia w przypadku, gdy wydarzenie organizowane jest przez firmę zajmującą się organizacją konferencji, a którego inicjatorem i organizatorem merytorycznym jest np. towarzystwo naukowe. W przypadku braku wsparcia ze strony wyspecjalizowanej firmy, towarzystwo naukowe musiałoby samo przeprowadzić powyższe działania. Sam fakt występowania pośrednika w przekazaniu świadczeń (nie tylko finansowych) ostatecznemu beneficjentowi, nie zwalnia nas z obowiązku upublicznienia informacji o zakresie i wartości współpracy z organizacjami ochrony zdrowia. Pominięcie publikacji takich informacji wprowadzałoby opinię publiczną w błąd, ponieważ znacząca część współpracy, odbywająca się za pośrednictwem innych podmiotów, np. organizatorów logistycznych wydarzeń, nie byłaby upubliczniana.
Przykład:
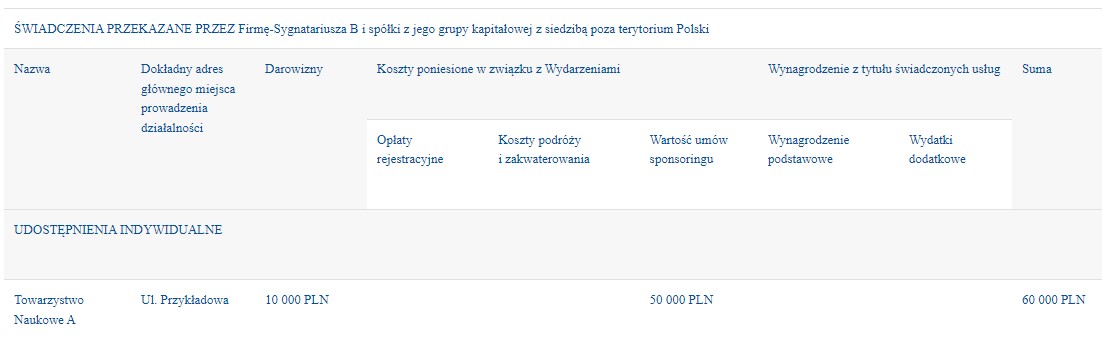
-
Świadczenia powinny być zawsze raportowane na rzecz inicjatora i gospodarza danego Wydarzenia. Jeśli inicjatorem i gospodarzem wydarzenia jest podmiot komercyjny (np. wydawnictwo), a organizacja ochrony zdrowia występuję w roli patrona lub partnera danego wydarzenia i nie ma wpływu merytorycznego na program i treści lub nie otrzymuje żadnych świadczeń raportowaniu podlega organizator logistyczny kwalifikowany jako organizacja ochrony zdrowia zgodnie z definicją zawartą w Kodeksie.Natomiast jeżeli organizacja ochrony zdrowia otrzymuje świadczenie lub ma wpływ merytoryczny na program i treści wydarzenia wówczas podlega raportowaniu i jest traktowany jako Beneficjent świadczenia.
Przykład:
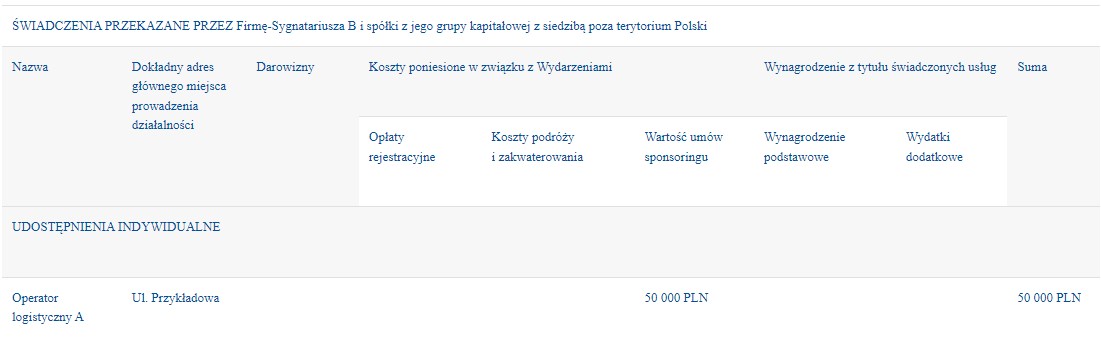
- Świadczenie raportowane jest dla podmiotu z osobowością prawną, któremu podlega dana osoba/komitet naukowy. Jeżeli placówka medyczna podlega pod oddział towarzystwa, a oddział podlega pod towarzystwo główne i oba podmioty mają ten sam numer NIP i KRS Świadczenie raportowane jest na rzecz głównego towarzystwa.
-
Co do zasady, świadczenia dla indywidualnych przedstawicieli zawodów medycznych (np. opłaty rejestracyjne, pokrycie kosztów podróży, zakwaterowania, wynagrodzenie za wygłoszenie wykładu sponsorowanego) nie powinny stanowić części świadczenia sponsoringowego raportowanego na rzecz organizacji ochrony zdrowia.
Rekomendowanym rozwiązaniem przy realizacji sesji sponsorowanej jest zawieranie umów na wykład sponsorowany bezpośrednio pomiędzy Sygnatariuszem, a wykładowcą. Na ten samej zasadzie rekomendowanym rozwiązaniem jest zawieranie indywidualnych umów (tzw. umowy delegowania/ finansowania) z lekarzami, zapraszanymi na wydarzenie przez Sygnatariusza Kodeksu w charakterze uczestników.
-
W przypadku, gdy część świadczenia przekazanego organizacji ochrony zdrowia (HCO) przeznaczona jest na świadczenia na rzecz indywidualnych przedstawicieli zawodów medycznych (HCP) zapraszanych przez Sygnatariuszy Kodeksu lub wykonujących świadczenia na ich rzecz (np. jako wynagrodzenie za wykład sponsorowany (tzw. sesja satelitarna), pokrycie kosztów udziału w konferencji, takich jak: opłata rejestracyjna, koszty podróży lub zakwaterowania, wymagany jest podział przekazanej kwoty wg kategorii i przypisanie wartości do Beneficjentów docelowych, np.:
- X PLN na opłaty rejestracyjne, koszty podróży, zakwaterowania (jeśli dotyczy) dla N HCP (imienna informacja),
- Y PLN na wykład lub inne wykonane usługi (np. moderowanie sesji) HCP (imienna informacja),
- Z PLN pozostałe koszty logistyczne związane z uczestnictwem HCP zapraszanych przez Sygnatariusza Kodeksu w wydarzeniu (zakwaterowanie, transport).
Jeśli zaproszenia na wydarzenie nie są dostępne na rynku i nie jest możliwe wskazanie jednostkowej wartości rynkowej opłaty rejestracyjnej, organizator powinien ją oszacować z dołożeniem należytej staranności, tak, aby świadczenie mogło zostać upublicznione jako indywidualne świadczenie dla Przedstawiciela zawodu medycznego zaproszonego przez Sygnatariusza Kodeksu.
Jeśli oszacowanie, o którym mowa w zdaniu powyższym, nie jest możliwe, Świadczenie należy przypisać organizacji ochrony zdrowia będącej organizatorem.
Transparentna informacja o podziale przekazanego Świadczenia powinna być wyszczególniona w umowie z organizacją ochrony zdrowia lub z organizatorem logistycznym.
W przypadku, gdy całość lub część świadczenia zostanie pośrednio przekazana przedstawicielom zawodów medycznych, organizacja ochrony zdrowia powinna uzyskać ich zgodę na udostępnienie danych osobowych.
Sygnatariusze Kodeksu zobowiązani są do podawania do publicznej wiadomości listy organizacji pacjentów, którym przekazują pomoc pieniężną lub niepieniężną (bezpośrednią lub pośrednią), oraz z którymi zawarli stosowne umowy.
W przypadku organizacji pacjentów zakres danych obejmuje nazwę organizacji oraz informację o charakterze udzielonej pomocy lub rodzaju świadczonych usług. Pomoc przekazana organizacji Pacjentów może mieć charakter pieniężny i niepieniężny. Należy także pamiętać, że udostępnieniu podlega również wsparcie przekazane przez podmiot trzeci działający na zlecenie Sygnatariusza Kodeksu.
Informacje, o których mowa powyżej powinny być udostępniane w cyklu rocznym, przy czym każdy okres raportowany obejmuje pełny rok kalendarzowy. Publikacja następuje na stronie internetowej Sygnatariusza Kodeksu (na poziomie krajowym lub europejskim).
Każdy Sygnatariusz Kodeksu publikuje informacje o przyjętej metodologii przygotowania listy i zasadach ustalania rodzaju i wartości przekazanego wsparcia.
W raportach udostępnione są następujące dane Organizacji pacjentów:
Obowiązujący od 1 stycznia 2021 roku Kodek Dobrych Praktyk INFARMA został przyjęty przez 28 firm farmaceutycznych – Sygnatariuszy Kodeksu. Kodeks jest otwarty do przystąpienia dla wszystkich przedsiębiorców z branży farmaceutycznej.
https://www.infarma.pl/etyka/lista-sygnatariuszy-kodeksu-dobrych-praktyk-infarma/
Kodeks Przejrzystości został przyjęty w 2015 roku przez 34 firmy farmaceutyczne, sygnatariuszy Kodeksu Przejrzystości Związku Innowacyjnych Firm Farmaceutycznych INFARMA.
- ABBVIE Polska Sp. z o.o.,
- ACTELION Pharma Polska Sp. z o.o.,
- ALLERGAN Sp. z o.o.,
- ALMIRALL Sp. z o.o.,
- AMGEN BIOTECHNOLOGIA Sp. z o.o.,
- ANGELINI Pharma Polska Sp. z o.o.,
- ASTELLAS PHARMA Sp. z o.o.,
- ASTRAZENECA PHARMA POLAND Sp. z o.o.,
- BAYER Sp. z o.o.,
- BIOGEN IDEC POLAND Sp. z o.o.,
- BOEHRINGER INGELHEIM MARKETING Sp. z o.o.,
- BRISTOL – MYERS SQUIBB POLSKA Sp. z o.o.,
- CELGENE Sp. z o.o.,
- CHIESI POLAND Sp. z o.o.,
- ELI LILLY POLSKA Sp. z o.o.,
- GSK COMMERCIAL Sp. z o.o.,
- IPSEN POLAND Sp. z o.o.,
- JANSSEN-CILAG POLSKA Sp. z o.o.,
- LEO PHARMA Sp. z o.o.,
- LUNDBECK POLAND Sp. z o.o.,
- MERCK Sp. z o.o.,
- MSD POLSKA Sp. z o.o.,
- NOVARTIS POLAND Sp. z o.o.,
- NOVO NORDISK PHARMA Sp. z o.o.,
- PFIZER POLSKA Sp. z o.o.,
- PIERRE FABRE MEDICAMENT POLSKA Sp. z o.o.,
- SANOFI-AVENTIS Sp. z o.o.,
- SANOFI PASTEUR Sp. z o.o.,
- SERVIER POLSKA Sp. z o.o.,
- SHIRE POLSKA Sp. z o.o.,
- ROCHE POLSKA Sp. z o.o.,
- TAKEDA Polska Sp. z o.o.,
- TEVA PHARMACEUTICALS POLSKA Sp. z o.o.,
- UCB PHARMA Sp. z o.o



